Material necesario
- un vaso
- agua
- permanganato potásico (KMnO4)
- hidróxido sódico (NaOH)
- un caramelo con palito que contenga glucosa, fructosa, jarabe de glucosa u otro azúcar reductor.
¿Cómo se hace?
Se echa agua en el vaso y se disuelve una pequeña cantidad de permanganato potásico, la suficiente para que la disolución resultante adquiera un ligero tono violeta como se ve en el vídeo.
Una vez disuelto se añade en torno a 1 g (2 lentejas) de hidróxido sódico.
Se revuelve con el caramelo y se observa que a medida que el caramelo se disuelve, la disolución cambia de color varias veces. Los primeros cambios son rápidos, los últimos no tanto.
Si se calienta un poco el agua los cambios suceden a más velocidad.
Es importante usar muy poco permanganato ya que sino el color es un violeta muy oscuro y no se aprecian fácilmente los cambios.
¿Por qué cambia el color?
En pocas palabras:
A medida que el azúcar reductor presente en el caramelo se disuelve en el agua transforma al permanganato, de color violeta, en otros compuestos como manganato, de color verde o dióxido de magnaneso de color amarillo.
Sigue leyendo si quieres una explicación más detallada de lo que sucede.
Un poco de teoría
Las reacciones químicas de oxidación-reducción (redox) se caracterizan porque algunos elementos de las substancias que reaccionan intercambian electrones. La pérdida de electrones se denomina oxidación y su ganancia reducción.
Para poder establecer quien pierde y quien gana electrones, o sea quien se oxida y quien se reduce, hay que saber primero cuantos electrones tiene cada elemento. Esto no es tan sencillo como podría parecer ya que los elementos en un compuesto están unidos unos a otros y los electrones que participan en esa unión con frecuencia no se pueden atribuir claramente a uno u otro elemento. Para solventar esta cuestión, los químicos le asignan a cada uno de los elementos que participan el llamado número de oxidación. Los cambios, en el transcurso de una reacción, de este número que puede ser positivo, negativo o cero, permiten conocer si un elemento se oxida o se reduce. Si en la reacción un elemento aumenta su número de oxidación es que ha perdido electrones: se ha oxidado. Si el número de oxidación disminuye es que los electrones se han ganado, el elemento se ha reducido.
¿Qué sucede en el vaso?
En el vaso hay permanganato potásico (KMnO4) e hidróxido de sodio (NaOH) disueltos en agua. El caramelo que se ha utilizado contiene según el fabricante: azúcar (de mesa) y jarabe de glucosa.
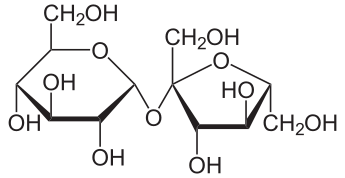
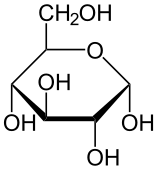
El azúcar es sacarosa, un disacárido formado por glucosa y fructosa unidas que no es reductor.
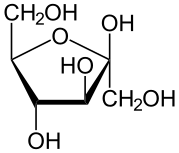
El jarabe de glucosa es un producto edulcorante usado en la industria alimentaria que contiene una mezcla de dos monosacáridos, ambos reductores, glucosa y fructosa .

El KMnO4 se disuelve en agua dando lugar al ión permanganato, MnO4−. En este ión el Mn tiene un número de oxidación +7. El azúcar reduce al Mn de +7 a +6, pasando el permanganato, MnO4−, a manganato, MnO42–, que presenta color verde. Una posible explicación para el azul intermedio es la coexistencia durante un tiempo de ambos compuestos MnO4− y MnO42–.

Al seguir añadiendo azúcar reductor a la disolución el Mn se reduce todavía más pasando el manganato a dióxido de manganeso MnO2 en el que el manganeso tiene un estado de oxidación de +4.
Más información
- Más información sobre lo que sucede: Química de colores: reacciones redox con chupachups
- Una forma alternativa de hacerlo: Chemical Chameleon
